Журнал "Макрогетероциклы"
Журнал является форумом специалистов, изучающих макрогетероциклические соединения
Навигация
Новости
Web of Knowledge определил Импакт фактор журнала Макрогетероциклы за 2021 год: 1.200 (JCR 2021).
Поиск
ISSN 1998-9539
Пиколиламиды эремомицина и катионные липогликопептиды на их основе: cинтез и оценка антимикробных свойств
Е. И. Моисеенко,a Н. Э. Грамматикова,a А. Е. Щекотихинa,b@
aИнститут по изысканию новых антибиотиков имени Г.Ф. Гаузе, 119021 Москва, Российская Федерация
bРоссийский химико-технологический университет имени Д.И. Менделеева, 125047 Москва, Российская Федерация
@E-mail: shchekotikhin@mail.ru
DOI: 10.6060/mhc181216s
Макрогетероциклы 2019 12(1) 98-106
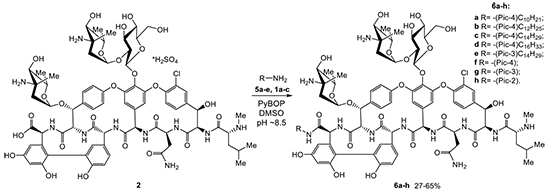
Описаны синтез и свойства новых полусинтетических производных гликопептидного антибиотика эремомицина (2) – катионных липоамидов эремомицина (6a-e), а также пиколиламидов эремомицина (6f-h). Новые гликопептиды были получены трансформацией карбокcильной группы эремомицина в карбоксамидную с использованием пиколиламинов и их соответствующих производных в присутствии PyBOP в качестве конденсирующего агента в ДМСО. Строение всех пиколиламидов эремомицина было подтверждено масс-спектрометрией высокого разрешения (HRMS ESI), а чистота и индивидуальность полученных образцов – методом ВЭЖХ. Кроме того, структура соединения 6e подтверждена 1H ЯМР спектрами. Исходные для получения пиколиламидов 6a-e кватернизованные пиколиламины 5a-e получены по трехстадийной схеме, включающей защиту аминогруппы, алкилирование гетероцикла и удаление защитной Boc-группы. Структура кватернизованных пиколиламинов 5a-e доказана совокупностью данных 1H и 13C ЯМР спектров, а также масс-спектров высокого разрешения (HRMS ESI). Исследование антибактериальных свойств показало, что пиколиламиды эремомицина обладают существенно большей активностью в отношении чувствительных к гликопептидам штаммов грамположительных патогенов по сравнению с исходным эремомицином, а также «золотым стандартом» – ванкомицином. Кватернизация пиридинового фрагмента длинноцепочечными алкилами приводит к увеличению активности производных 6a-e в отношении резистентных к гликопептидам штаммов, но сопровождается снижением активности в отношении чувствительных.
С полным текстом статьи можно ознакомиться на английской версии сайта
- 1279 просмотров
- English